¿Cuál es el proceso que sigue un fármaco para su uso y distribución?
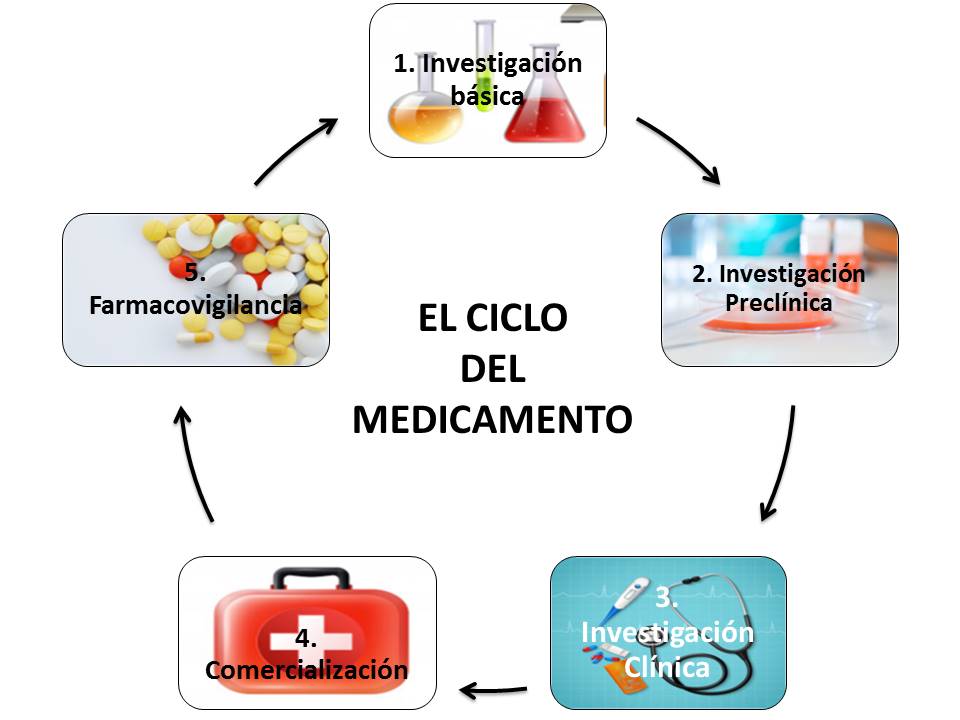
Para que un fármaco sea aprobado para uso humano, pasa por una serie de etapas, o ciclo del medicamento:
Fase I: Investigación básica
En esta etapa se plantea una sustancia como posible fármaco y se establece su diana terapéutica, es decir, hacia qué molécula va dirigido el fármaco. Esta etapa es compleja, ya que el descubrimiento de un medicamento nuevo no es fácil, y es un proceso largo y con una tasa de éxito muy baja. Se estima que solo 250 de cada 10.000 moléculas de la etapa de investigación básica pasan a la fase de investigación preclínica.
Fase II: Preclínica
En esta fase se analiza el compuesto seleccionado en el laboratorio para evaluar la seguridad de su administración en humanos y su actividad biológica. Lo que se pretende es averiguar cómo se distribuye o elimina el medicamento del organismo y conocer sus efectos, a distintas dosis, en diferentes órganos y sistemas, entre otros objetivos. Para ello, se realizan ensayos en células en cultivo, se formula el medicamento y se hacen estudios de farmacología y toxicología.
Fase III: Clínica
Esta fase de investigación clínica es necesaria para saber cómo actúa el medicamento en las personas y para averiguar si se trata de un medicamento adecuado y eficaz en el tratamiento de la enfermedad, con un perfil de seguridad óptimo. Es una etapa relativamente larga, donde se demuestra la seguridad del compuesto, se buscan las dosis adecuadas y se evalúan la eficacia y seguridad del tratamiento experimental, sobre una población seleccionada para el estudio. Proporciona la base para la aprobación del fármaco.
Fase IV: Aprobación y Registro
En esta fase se lleva a cabo la solicitud de la autorización para la comercialización del fármaco a las agencias reguladoras competentes.
Fase V: Vigilancia continuada
Una vez autorizado el fármaco y tras su comercialización se hace una vigilancia continuada para estudiar su efectividad y seguridad en la utilización clínica diaria ya que, cuando sale al mercado, su uso se expande a miles-millones de pacientes de todo el mundo, muy diferentes entre sí, produciéndose condiciones y posibles interacciones no identificadas previamente. Esta es la etapa de farmacovigilancia.
Este seguimiento detallado de las incidencias que pueda generar el producto, permiten modificar la información relativa a las recomendaciones de uso, modificar la información contenida en efectos secundarios y permiten retirar el fármaco del mercado en el caso de que sea necesario. Por eso, garantiza la seguridad de los pacientes.
¿Quién participa en la farmacovigilancia?
Es cosa de todos. Se trata de una responsabilidad compartida por las autoridades sanitarias, por la industria farmacéutica, por los profesionales sanitarios y por los propios ciudadanos. Su éxito reside en la colaboración de todas las partes involucradas.
El Sistema Español de Farmacovigilancia apareció ante la necesidad de vigilar los posibles problemas relacionados con el uso de los medicamentos. En España la antigua Ley del Medicamento de 1990 ya recogía la importancia de que los profesionales de la sanidad participaran en la protección de la salud, pero no es hasta el año 2002 cuando se regula por ley (RD 711/2002, de 19 de julio). Actualmente ese RD 711/2002 ha sido derogado y sustituido por el Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano.
Los médicos, farmacéuticos, enfermeros y demás profesionales de la salud tienen la obligación de notificar toda sospecha de reacción adversa a medicamentos, y enviarla de manera urgente al correspondiente Centro Autonómico de Farmacovigilancia.
Tras la notificación, el comité técnico de farmacovigilancia de la Agencia, evalúa la importancia de la reacción y adopta las medidas adecuadas que pueden llegar a la retirada temporal o definitiva del medicamento y, por supuesto, informa a todos los agentes sanitarios implicados.
Aunque son las autoridades competentes las que deben informar y actuar en caso de descubrir una posible reacción adversa, los pacientes también deben notificar a su médico o farmacéutico cualquier reacción aparentemente relacionada con un medicamento que esté utilizando, para contribuir activamente a la seguridad de todos.
La farmacovigilancia nos garantiza la seguridad de un medicamento, ya que garantiza que el efecto adverso detectado tiene una incidencia mucho menor que el beneficio de la administración del mismo.

Farmacovigilancia de las vacunas
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), valora permanente las sospechas de reacciones adversas notificadas en España con todos los medicamentos autorizados, incluyendo las vacunas.
Las vacunas son medicamentos particulares y su regulación también. Al vacunarse millones de personas, es necesario conocer cualquier acontecimiento adverso que ocurra un tiempo después de la vacunación y analizar, entre otros factores, si ocurre con más frecuencia que lo que se espera que ocurra en general en la población. Por eso se recoge cualquier acontecimiento adverso asociado temporalmente tras su administración, sin que exista la sospecha de que la vacuna pueda haberlo originado, ya que puede tratarse de problemas médicos que coinciden en el tiempo o que estén relacionados con el propio acto de la vacunación.
En caso de que el número de acontecimientos que se recoja tras la vacunación sea superior a lo que esperamos que ocurra en la población, se realiza una evaluación amplia y detallada con toda la información disponible en la UE; las notificaciones recogidas en España forman parte de las evaluaciones europeas. Así, la AEMPS, organismo público e independiente, junto con el resto de agencias de la UE y la coordinación de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés), realiza una evaluación continuada de los datos para detectar reacciones adversas no identificadas durante los ensayos clínicos de las vacunas.
Por lo tanto, la farmacovigilancia garantiza que todo medicamento autorizado para uso humano, incluidas las vacunas, son seguros y que la probabilidad de que se produzca un efecto adverso es mínima, siendo siempre mucho mayor el beneficio aportado por el tratamiento.
Así, podemos concluir que la farmacovigilancia:
- Es una actividad de salud pública cuyo objetivo es la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos una vez comercializados,
- permite el seguimiento de los posibles efectos adversos de los fármacos
- proporciona de forma continuada la información sobre la seguridad de los medicamentos
- posibilita la adopción de las medidas oportunas,
- asegura que los medicamentos disponibles presentan una relación beneficio-riesgo favorable para las personas
- garantiza la seguridad de los medicamentos que consumimos




